Hàm lượng kháng nguyên đăng ký của vắc xin dao động từ 3,9-10,4 U/liều
Chiều 16/9, lãnh đạo Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm y tế (Bộ Y tế) cho biết, vắc xin Vero Cell trên nhãn ghi mỗi lọ tiêm 2 liều, mỗi liều tiêm 0,5 ml, tương đương mỗi liều có 6,5 U (đây chính là hàm lượng kháng nguyên đăng ký).
"Theo tiêu chuẩn đã được Bộ Y tế phê duyệt, hàm lượng kháng nguyên của sản phẩm cho phép trong khoảng từ 50 đến 200% hàm lượng đăng ký. Thực tế các lô đã nhập khẩu đều có hàm lượng kháng nguyên không nằm ngoài khoảng 3,9-10,4 U/liều (60-160%). Do đó, kết quả hàm lượng kháng nguyên của các lô vắc xin Vero Cell trên phiếu kiểm nghiệm ghi 7,2, 7,4 7,8 hoặc 6,9 U/liều nằm trong khoảng cho phép trên là đạt yêu cầu", vị lãnh đạo này nói.
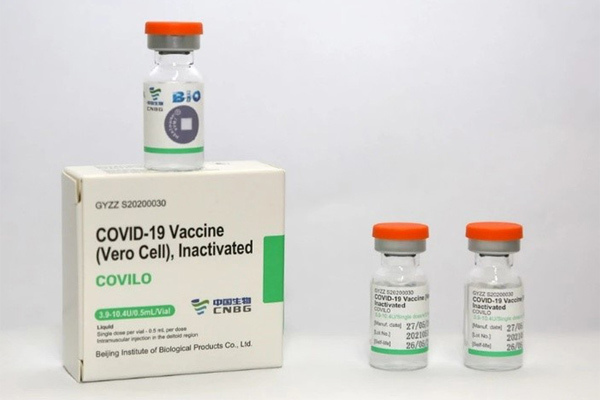
Trước đó, theo Tổng cục Hải quan, một số lô hàng vắc xin Covid-19 Vero Cell nhập khẩu ngày 8/7 cho thấy hoạt chất, hàm lượng/nồng độ trên Giấy phép số 7929 là 6,5 U kháng nguyên SARS-CoV-2 bất hoạt, nhưng trên phiếu kiểm nghiệm có kết quả là 7,2 U; 7,4 U; 7,8 U hoặc 6,9 U…
Để đảm bảo hàng hóa nhập khẩu đúng quy định của Luật Dược năm 2016, Tổng cục Hải quan yêu cầu Cục Hải quan TP.HCM lấy mẫu trưng cầu giám định tại các cơ sở kiểm nghiệm vắc xin của Bộ Y tế để xác định thực tế hoạt chất, hàm lượng/nồng độ của kháng nguyên SARS CoV-2 bất hoạt.
Trường hợp kết quả giám định xác định hoạt chất, hàm lượng/nồng độ khác so với giấy phép nhập khẩu thì báo cáo kết quả về Tổng cục Hải quan để trao đổi với Cục Quản lý Dược (Bộ Y tế) phối hợp xử lý.
Cũng theo đại diện lãnh đạo Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm y tế, như các vắc xin phòng Covid-19 khác, vắc xin Vero Cell cũng phải được kiểm định và cấp giấy chứng nhận trước khi đưa ra sử dụng tiêm cho người dân.
Đồng thời, vắc xin này cũng được Bộ Y tế cấp phép lưu hành có điều kiện trong tình huống cấp bách giống như các vắc xin Covid-19 khác. Theo đó, tại Quyết định số 2763 ngày 3/6, vắc xin Vero Cell đã được Bộ Y tế cấp phép lưu hành trong tình huống cấp bách và có điều kiện.
Trước đó, vắc xin Vero Cell đã được Tổ chức Y tế Thế giới (WHO) tiền thẩm định và nằm trong hệ thống COVAX Facility, nên việc kiểm định của Việt Nam cũng tuân thủ theo hướng dẫn của WHO dành cho vắc xin Covid-19 trong trường hợp khẩn cấp.
Việc kiểm định chất lượng bao gồm nhiều nội dung: Đánh giá hồ sơ sản xuất, mẫu của lô sản phẩm, giấy phép xuất xưởng NRA (Cơ quan quản lý vắc xin quốc gia), giấy chứng nhận phân tích (COA) của nhà sản xuất, đánh giá dây chuyền bảo quản lạnh trong quá trình nhập và vận chuyển vắc xin (để cấp giấy chứng nhận xuất xưởng trước khi lưu hành)...
Quy trình kiểm định vắc xin Covid-19 thế nào?
Lãnh đạo Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm y tế cho biết, quy trình kiểm định vắc xin Covid-19 diễn ra như sau:
- Đơn vị gửi mẫu kiểm định, gửi hồ sơ tóm tắt của lô vắc xin cần kiểm định.
- Nhân viên Khoa Xuất xưởng kiểm tra cảm quan dây chuyền lạnh vắc xin và sinh phẩm, đối chiếu số đăng ký của sản phẩm hoặc công văn cho phép của Cục Quản lý Dược, Bộ Y tế. Cán bộ chuyên trách giao mẫu kiểm định cho các khoa kiểm định chất lượng để thử nghiệm vắc xin trong vòng 24 giờ.
- Khoa Xuất xưởng xét hồ sơ ngay kể từ ngày nhận. Trường hợp phát hiện hồ sơ chưa đạt yêu cầu phải báo cáo với Trưởng khoa để xem xét, liên hệ với đơn vị gửi mẫu để bổ sung hoặc giải trình.
Nếu đơn vị gửi mẫu không trả lời, giải trình theo thời gian quy định, Viện sẽ trả lời lô vắc xin không đạt yêu cầu.
- Khi nhận được mẫu từ Khoa Xuất xưởng, Khoa Kiểm định chất lượng triển khai ngay các thử nghiệm theo quy định và tuân thủ theo thời gian được chỉ đạo bởi lãnh đạo Viện.
Trong quá trình thử nghiệm, nếu phát hiện sự cố, cần chuyển lại ngay cho Khoa Xuất xưởng và trình lãnh đạo xem xét.
- Sau khi hoàn tất, cán bộ Khoa Xuất xưởng nhận lại kết quả kiểm định, so sánh với kết quả kiểm định của nhà sản xuất (nếu có) và rà soát lại hồ sơ, bằng chứng dây chuyền lạnh. Nếu tất cả kết quả đều đạt, chuẩn bị sẵn 3 bản gốc giấy chứng nhận xuất xưởng vắc xin, phiếu kết quả phân tích theo mẫu.
Trường hợp không đạt cũng tương tự, ngoài in mẫu chứng nhận không đạt, cần soạn công văn gửi Cục Quản lý Dược về kết quả lô không đạt.
Trong kết luận của giấy chứng nhận xuất xưởng phải ghi rõ lô vắc xin đạt yêu cầu về nội dung nào, theo tiêu chuẩn nào.
Trong quá trình kiểm định, nếu cán bộ Khoa Kiểm định chất lượng có thắc mắc về thử nghiệm, có thể trực tiếp tiếp xúc với hồ sơ đăng ký, hồ sơ lô khi được Trưởng khoa Xuất xưởng đồng ý, nhưng chỉ được xem tại chỗ, để tuân thủ nguyên tắc bảo mật.
Lãnh đạo Viện sau khi xem xét thấy hồ sơ đạt yêu cầu sẽ chuyển toàn bộ hồ sơ và giấy chứng nhận xuất xưởng đã phê duyệt cho văn thư đóng dấu. Sau đó chuyển tiếp hồ sơ, giấy chứng nhận đến Cục Quản lý Dược và Chương trình Tiêm chủng mở rộng quốc gia.
"Việc kiểm định vắc xin Vero Cell cũng giống như các vắc xin Covid-19 khác trước đó đã về Việt Nam được tiến hành theo đúng quy trình nghiêm ngặt như trên. Đây là quy định bắt buộc", Đại diện lãnh đạo của Viện cho biết thêm.
Quy định chung cho kiểm định vắc xin phòng Covid-19 của Bộ Y tế theo hướng dẫn của WHO là cấp chứng nhận xuất xưởng 48 giờ sau khi nhận được đầy đủ mẫu, hồ sơ lô, bằng chứng về dây chuyền lạnh đạt yêu cầu.
(Theo Sức khỏe Đời sống)
Hà Nội nhận thêm hơn 400.000 liều vắc xin Sinopharm
Ngày 13/9, Hà Nội nhận thêm 418.200 liều vắc xin Sinopharm. Số vắc xin này sau đó được phân bổ cho 13 quận, huyện.



